의약품 설계 기반 품질 고도화(QbD)를 위한 QbD 6시그마 체계 구축에 관한 연구
A Study on the Build of a QbD Six Sigma System to Promote Quality Improvement(QbD) Based on Drug Design
Article information
Trans Abstract
Purpose
This study proposes the application of Six Sigma management innovation method for more systematically enhanced execution of Quality by Design (QbD) activities. QbD requires a deeper understanding of the product and process at the design and development stage of the drug, and it is very important to ensure that no fault is fundamentally generated through thorough process control.
Methods
Analyzing the background and specific procedures of quality improvement based on the drug design basis, and analyzing the key contents of each step, we have differentated and common points from the 6 Sigma methodology. We propose a new model of Six Sigma management innovation method suitable for phar- maceutical industry.
Results
Regulatory agencies are demanding results from statistical analysis as a scientific basis in developing medicines to treat human life through quality improvement activities based on drug design. By utilizing the education system to improve the statistical analysis capacity in the Six Sigma activities and operating the 6 Sigma Belt system in conjunction, it helped systematically strengthen the execution power of quality improvement activities based on pharmaceutical design based on the members of the pharmaceutical industry.
Conclusion
By using QbD Six Sigma, which combines quality enhancement based on pharmaceutical design basis and Six Sigma methodology suitable for pharmaceutical industry, it is possible to obtain satisfactory results both by pharmaceutical companies and regulators by using appropriate statistical analysis methods for preparing scientific evidence data required by regulatory.
1. 서 론
2005년 이후 연평균 6%대의 안정적인 성장세를 보이는 의약품의 수요증가는 인구 고령화와 함께 만성질환과 신종 질병의 증가에 따라 나타나는 현상으로서 세계경제의 저성장 기조에도 성장세이다. 세계의약품 시장은 2016년 1조1천억 달러(약 1,430조 원)규모로 7% 대의 성장세를 보이며 2025년에는 최대 3조 달러(약 3900조 원)규모의 시장으로 대폭 확대될 전망이다. 미국은 제약 산업의 영업 이익율(23%)은 반도체(18.2%), 화학(8.8%), 자동차(4.1%)보다 높다. 의약품의 개발 및 생산은 국내 시장 의약품의 수요에 맞춰 생산을 통해 공급하고, 수출로 의료 비용 및 사회적 비용을 감소시킬 수 있다. 국내의 제약업체들이 의약품의 개발기술과 생산기술이 국제적 요구에 충족되지 못하면 앞으로의 성장은 기대할 수 없다(Yim, 2018; Kim and Rhee, 2020).
의약품 설계기반 품질고도화(Quality by Design, QbD)는 1992년 Joseph M. Juran 박사가 제안하였다. 품질은 계획이나 설계를 통해서 확보할 수 있고, 평가나 관리로는 충분히 확보될 수 없다고 주장하였다. 미국과 유럽연합(EU), 일본이 주축이 되어 1990년 설립된 국제의약품 규제조화회의체(The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use, ICH)의 품질(Quality, Q)가이드라인에 QbD 핵심사항이 설명되었다. ICH Q8에는 의약품 개발 Q9에는 품질 위해 관리 Q10에는 의약품 품질 체계 Q11에는 원료의약품 개발 및 제조에 관한 개념이 설명되어 있다. ICH는 국가별 요구사항이 상이한 국제의약품 허가 조건 들에 대해 제약회사들이 상이한 요청사항에서 필요하지 않은 비용과 적기에 출시 못하는 사태로 인해 의약품의 가격 상승과 공급 지연을 유발하여 고통 받는 환자들에게 불이익이 되는 문제를 풀기 위해 태동하였다. 우리나라는 6번째로 2016년에 ICH회원국으로 가입했다. ICH는 의약품 허가 관련 요구사항의 국제적 조율이 주요 목적인 국제 기구이다. ICH Q8(R2)에서는 QbD가 가장 먼저 목표를 정하여 시작한다는 개념과 과학적인 기법으로 품질 위험 평가를 바탕으로 첫째, 제품의 이해. 둘째, 공정의 이해. 셋째, 공정 관리를 강조하는 체계적인 우수의약품 품질고도화 개발 방식이라고 정의하고 있다(Kim and Rhee, 2020).
2019년 전 세계를 펜데믹으로 빠뜨린 코로나 사태뿐만 아니라 2009년 신종플루사태 때에도 국내 제약 회사들의 기술력으로 개발 및 생산한 백신이 있어 위기를 극복하였다. 의약품을 개발하고 생산할 수 있는 국가안보차원에서의 제약주권의 확보는 국민의 삶의 질과 생명과 건강에도 연결된다. 2013년 UN은 제약 산업이 타국에만 의존할 게 아니라 자체적으로 생산하고 공급할 수 있는지가 그 나라의 건강권을 위한 핵심사항이라고 강조하였다. 세계에서 가장 큰 제약시장은 미국(40.2%)이고, 유럽(13.5%)인데, 세계 의약품 시장의 절반 이상을 점유하고 있다. 글로벌 신약 회사로 국내 제약사들이 발전하기 위해서는 QbD의 적용이 시급하다.
국내 제약사는 오랜 전통을 갖고 있는 회사가 있고, 태동한 지 10년이 채 안 되는 신생기업이 많다. 역사와 전통이 있는 제약사는 오너체제를 유지하고 있어, 오너의 생각대로 경영이 이루어지는 경향이 크고, 신생기업은 제품개발이나 생산에 집중하여 QbD의 도입의 중요성과 필요성을 제대로 인지하지 못하고 있다. 더불어 필요성과 중요성을 가지고 있더라도 이를 어떻게 적용하고 제품 개발에 반영해야할지 모르고 있는 것이 현실이다. 식약처나 유관 기관에서 시행하는 세미나와 교육이 접할 수 있는 전부인데, 그것만으로는 QbD 담당자도 없는 제약회사들이 QbD를 적용할 수가 없다. 이에 본 논문은 필수적으로 적용해야 하는 QbD를 국내 제약사들에 조기에 정착하고 내재화할 수 있는 전략으로 기존의 품질경영체계였던 6시그마에 접목하여 QbD를 전파하는 것을 시도하였고, 성공한 사례를 구체적으로 설명한 QbD 6시그마를 제안하였다.
2. 이론적 배경 및 선행연구
2.1 ICH 가이드라인
ICH 가이드라인은 크게 4가지로 분류된다. Table 1과 같이 첫 번째 Q는 품질 가이드라인으로써 의약품의 불순물 관리 기준 안정성 연구, GMP 위험 관리를 바탕으로 의약품 품질 관리가 포함되어 있다. GMP는 Good Manufacturing Practice의 약자로 우수한 의약품을 제조 공급하기 위하여 모든 공정관리와 출하에 이르는 사항을 규정한 기준이다. 1962년 미연방 식품, 의약품, 화장품법(Federal Food, Drug and Cosmetic Act, FD&C)의 개정 법률안에서 처음 공식적으로 사용되었다. 이 중 Q8부터 Q11까지가 QbD 관련 가이드라인이다. 두 번째 E는 Efficacy 가이드라인으로써 임상실험의 설계, 수행, 안전성, 보고와 관련된 가이드라인을 포함하고 있고, 새로운 형태의 바이오의약품, 약리유전학, 유전체학 기술 등에 대한 사항도 다룬다. 세 번째 S는 Safety 가이드라인으로 발암성, 유전독성, 재생독성에 대한 사항을 포함하고 있다. 마지막으로 M은 Multidisciplinary 가이드라인으로 Q나 E, S 가이드로 분류되지 않는 내용들에 관한 가이드라인이다.
Table 2는 ICH 가이드라인에서 QbD에 관련된 Q8, Q9, Q10, Q11에 대하여 핵심적으로 다루는 사항에 대해 요약하였다.
신약승인신청(New drug applications, NDA), 임상신약신청(Investigational new drug application, IND), 약식 제너릭 의약품허가신청(Abbreviated new drug applications, ANDAs), 생물의약품신약승인신청(Biologics license applications, BLAs) 및 기술된 신약승인 신청에 QbD를 도입하여 제출하는 것이 증가하고 있고, CMC(Chemistry, Manufacturing and Controls) Reviewer들이 검토할 때 ICH 규정의 폭 넓은 적용이 필요하다는 것을 인식하고 응용하고 이에 대한 정책에 대하여 CMC검토에서의 ICH 규정의 적용원칙이 발표되었다. 주요 내용으로는 허가신청서는 ICH Q8(R2)에 따라 품질목표사항(Quality Target Product Profile, QTPP), 핵심품질특성(Critical Quality Attribute, CQA)이 포함되어야 하며, ICH Q8(R2)에 근거하여 의약품의 개발 및 생산과정에 대한 이해가 내포되어 있어야만 한다. 의약품의 안전성과 효능에 영향을 주는 의약품 원료물질 첨가제 및 밀폐용기시스템에 관한 확인. 허가신청서에 기재된 과학 및 위험 접근 방식에 대해 ICH Q9에 기재된 방법을 사용하여 평가해야 한다고 명시되어 있다(Kim and Rhee, 2020).
2.2 QbD 절차
QbD는 우수의약품 설계 기반 품질고도화로 설명한다. 21세기형 GMP로 볼 수 있으며 첨단 기술을 활용하여 의약품 생산 공정에서 발생할 수 있는 위험성을 예측하고 문제에 즉각 대처할 수 있는 세계적 수준의 선진적인 품질관리 방법론이다. 국내 제약 기업들의 글로벌 진출과 의약 제품의 안전성 및 품질향상을 위해 QbD에 대한 관심이 커지고 있다(Anurag, 2009).
의약품 개발과 품질 관리의 기존 방식은 제약 공정을 통해 의약품을 생산해서 환자에게 공급하는 흐름을 가지고 있는데, 제약 공정의 물질 특성과 공정 변수를 선정할 때 경험에 의존한 공정 조건을 선정하고, 단일 변수 실험으로 운영 범위를 선정함으로 최적 조건의 공정을 선정할 수 없어 품질이 좋은 의약품을 개발하기에는 어려움이 있다. 의약품의 생산에서 품질 특성에 대한 관리를 단순한 제품 테스트를 통해 관리하고, 소수의 배치 데이터를 통해 규격을 선정하게 되어 품질 관리에도 어려움이 있다. 환자에게 제공해야 하는 약의 안정성과 유효성의 관점으로 봤을 때 임상 결과와 품질특성 간의 관계가 불명확하고, 공정 조건을 고정하고 재현성 확보에 중점을 가지는 방식을 취하였는데, 이러한 의약품 개발과 품질 관리의 기존 방식은 테스트에 의존하고 있어 근본적으로 한계가 있다(Kim and Rhee, 2020).
QbD 방식은 기존 방식과는 반대흐름을 가진다. 환자의 안정성과 유효성의 관점에서 의약품의 품질 특성을 정하고 이에 따른 제약 공정의 물질 특성과 공정 변수를 선정하여 최적 조건을 실험계획법을 통해 찾아낸다. 환자의 안전성과 유효성에서 품질 특성을 찾아가는 과정에서 제품의 대한 이해가 필요하고, 품질 특성을 물질 특성과 공정 변수와 연결시키는 과정이 공정에 대한 이해가 필요하다. 순차적으로 제품에 대한 이해와 공정에 대한 이해를 충분히 한 후에 물질 특성과 공정 변수를 관리하는 공정관리를 수립하게 되면, 품질 좋은 의약품을 개발할 수 있다(Sara, 2020).
2.2.1 제품의 이해
제품의 이해 단계의 최종 결과물은 핵심품질특성(Critical Quality Attribute, CQA)이다. 먼저 품질목표사항(Quality Target Product Profile, QTPP)을 정하고, QTPP의 달성 정도를 판단하기 위한 정량적인 지표로 품질특성(Quality Attribute, QA)을 정하고, QA 중 치명도가 높은 항목을 CQA로 선정하는 것이다. QTPP는 목표 기술 단계로 ‘강희처럼 표준 몸매를 갖는다.’라고 한다면, CQA는 정량적 지표로서 허리 둘레 31인치 이하, 몸무게 72kg 이하, 엄지손가락 둘레 4cm 이하로 각각의 QA 중 CQA로 판단하기 어려운 것은 엄지손가락 둘레가 된다. 엄지손가락 둘레로 표준몸매 달성여부를 판단하기 어렵기 때문이다.
QTPP는 고객이 원하는 품질을 확보하기 위한 의약품의 예측적 품질 특성이고, 의약품의 안전성과 유효성을 감안해서 선정되어야 한다고 ICH Q8(R2)가이드에 제시되어 있다. 품질목표사항은 제품 개발을 위한 설계 근간이 되며, 다음의 사항들을 고려해야 한다. 첫째, 제제의 품질 기준, 둘 째, 함량, 셋째 활성 성분의 전달과 방출 또는 약동학적 특성, 넷째, 용기와 포장, 다섯째, 임상적 용도, 투여 경로 기준이다.
CQA는 중요품질특성이라고 하고, 식약처에서는 핵심품질특성으로 사용한다. 연구자들은 치명품질특성으로 사용하는 것이 정확한 표현이다. 핵심품질특성은 원하는 제품의 품질 수준을 보장하기 위한 한도와 범위, 분포를 가지는 생물학적, 미생물학적 물리적, 화학적 특성이라고 ICH Q8(R2)에 제시되어 있다. 내용 고형제의 경우 핵심품질특성은 주로 용출, 함량, 순도, 안정성에 영향을 주는 특성이다(Amit and Anil, 2013; Kim and Rhee, 2020).
2.2.2 공정의 이해
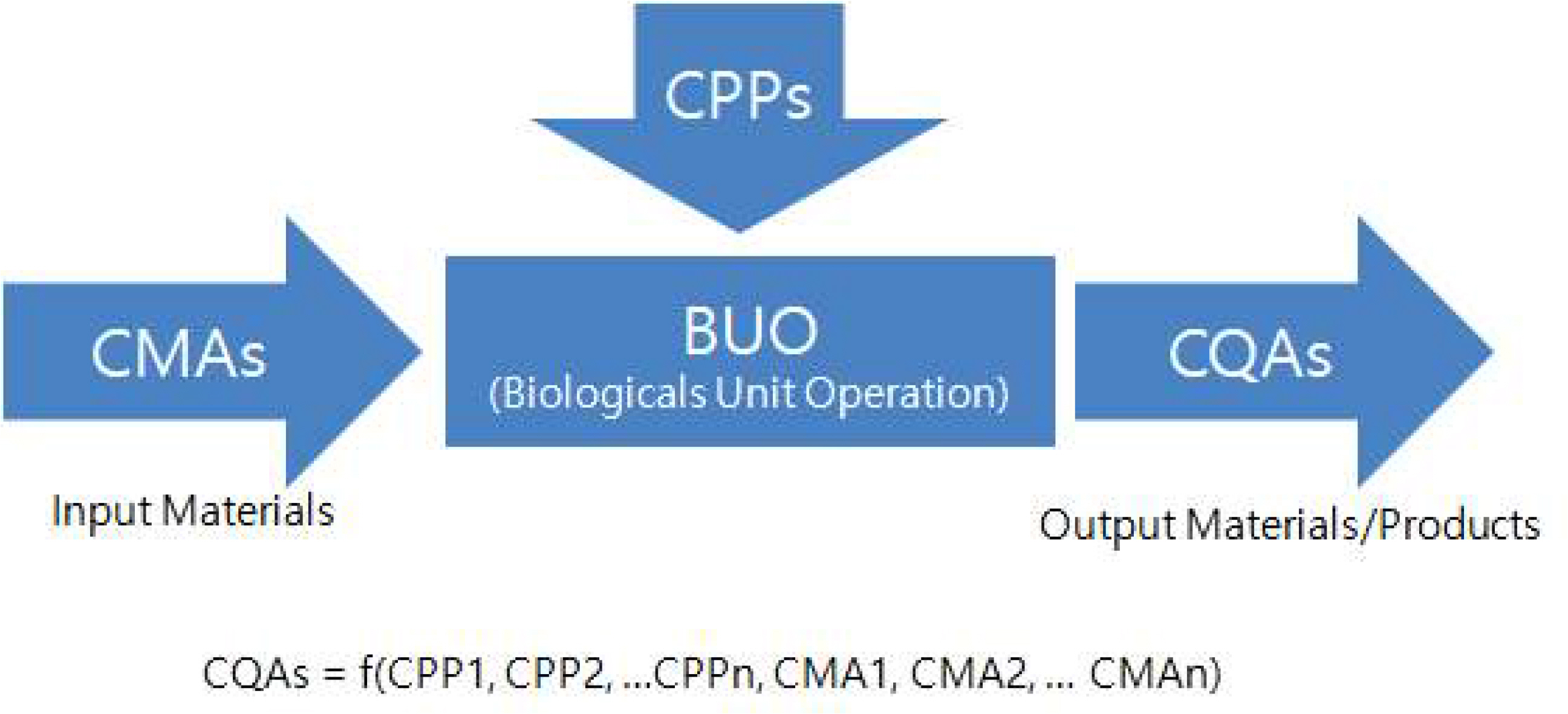
공정의 이해 단계의 최종 결과물은 핵심공정변수(Critical Process Parameter, CPP)와 핵심물질특성 (Critical Material Attribute, CMA)와 설계공간 (Design Space, DS)이다. CQA에 치명적인 영향을 주는 CPP나 CMA를 찾고 CQA 특성에 문제가 없는 한도내에서 CPP의 허용 범위인 DS를 도출하는 단계이다. 예를 들어 핵심품질특성이 허리 둘레 31인치 이하이면, CPP는 탄수화물 섭취량이 되고, DS는 300그램 이하로 정할 수 있다.
CPP는 CQA에 중요한 영향을 주는 핵심공정변수이다. 달성해야 할 수준의 품질을 확보하기 위해서 필수적으로 모니터링 및 관리되어야 한다고 ICH Q8(R2)가이드에 포함되어 있다.
Figure 1은 CMA와 CPP 그리고 CQA에 대한 관계에 대해 나타내었다. CMA와 CPP에 관련된 공정 변동성은 원료의 품질 변동, 원료 공급업체의 제조 공정의 변동에 따라 발생한다. 의약품의 개발 및 제품과 공정의 특성 에서 중요한 요소는 CQA에 영향을 주는 CPP와 CMA를 파악하고 관리하는 것이며, 통계분석결과를 바탕으로 하는 과학적인 증거가 뒷받침 되어야 한다(Kim and Rhee, 2020).
DS는 품질 보증과 연관된 공정 변수와 투입 변수의 다차원적 조합과 상호작용으로 ICH Q8(R2)가이드에 제시 되어 있다. 규제기관에서는 DS 안에서의 변경작업은 실제 변경으로 보지 않고, 이를 벗어나는 경우에만 변경으로 보고, 허가 기관에 변경 신고를 해야 한다. 또한 실험계획법(Design of Experiment, DOE)을 통해 동시에 여러 개의 변수를 함께 실험해야 파악이 가능하다(Gulin, 2019).
2.2.3 공정관리
DS까지 정의된 CQA에 중요한 영향을 미치는 변수들인 CPP에 대해 특정 범위 값 안에서 품질 관리를 위한 전략을 세우는 것이 품질관리단계에서 관리전략(Control Strategy, CS)이다. CS는 품질 관리 전략으로서 제품 및 공정 이해를 바탕으로 공정 성능과 제품 품질을 보장하기 위해 정한 관리 방안이라고 ICH Q8(R2)가이드에 제시되어 있다. 주성분 등 의약품 원료와 관련된 변수와 특성, 시설 및 설비 운전 조건, 공정 내 운영관리, 최종 제품 규격과 모니터링 및 관리 방법과 주기 등이 포함되어 있다(ICH Q8).
제품과 공정에 대한 이해가 증대된 QbD 방식의 관리 방법은 변동성이 발생하는 곳을 보다 체계적으로 파악하고, 초기 단계 관리를 강화하고 최종 제품 시험의 필요성을 최소화 하며, 변동성 관리를 위한 범위에 대해 보다 유연하게 접근이 가능하다. CS는 제품 및 공정에 대한 이해를 바탕으로 수립되고, 공정 개발 중 연구된 고위험 변수들 CPP, CMA에 대해 수립한다. 연구된 변수의 범위와 실제 작업 범위를 포함하고, 제품 전 주기에 걸쳐 얻은 경험을 바탕으로 품질 관리 전략은 지속적으로 업데이트 된다(Gulin, 2019).
2.3 6시그마 방법론
6시그마는 반세기 이상 전 세계적으로 활용되고 적용되는 유일한 경영혁신 기법이다. 한 때는 포춘지에서 선정한 100대 기업 중 80% 가량이 6시그마를 회사의 경영혁신 기법으로 채택하였다. 지금도 LG그룹은 6시그마를 전사적으로 시행하고 있다. 6시그마는 사전적 의미로는 6개의 표준편차를 의미하기도 하고, 100만개 중 3.4개의 불량 가능성을 가지는 높은 수준의 품질 수준을 의미하기도 하다 동시에 6시그마는 기업의 고유문화와 철학과 사상이 담겨있는 하나의 무형적인 가치다(Kim and Rhee, 2017).
Define, Measure, Analyze, Improve, Control 5단계로 문제를 해결하고 단계 별 영문 앞 글자를 따서 DMAIC라고 부르기도 한다. D단계는 Define단계로서 과제를 도출한 배경과 개선의 대상인 Project Y 선정 배경에 대한 이론적 근거 등을 기술하고, Logic Tree나 Pareto Chart 등이 사용된다. 필요시에는 품질기능전개(Quality Function Deployment, QFD)가 사용될 때고 있고, 고장모드영향분석(Failure Mode Effect Analysis, FMEA)이 사용되기도 한다. M단계는 Measure단계로 선정된 Project Y의 측정시스템에 대한 검증을 실시하여 정확도와 정밀도를 확인하고, 현재 수준을 공정능력지수(Capability Process, CP)나 Z값으로 측정하여 나타낸다. 현재 수준을 정확히 파악해야 개선의 방향을 수립할 수 있다. A단계는 Analyze단계로 Project Y에 영향을 주는 X 중에서 치명적인 X를 찾는 단계이다. 샤이니 시그마에서는 한 번에 하나의 X를 찾지만, 전통적인 6시그마 기법에서는 다양한 통계적 분석 기법을 활용하여 영향을 주는 치명인자를 P-value를 활용하여 모두 찾는다. (Kim and RHEE, 2017) I단계는 Improve단계로서 A단계에서 찾은 치명인자들의 수준을 최적화하여 Project Y를 개선하는 단계이고, 주로 실험계획법이 활용된다. 이 때 사용되는 실험계획법에는 주로 완전요인배치법과 부분요인배치법 반응표면법, 혼합물실험법이 사용된다. 마지막으로 C단계는 Control단계로서 Project Y의 성능을 유지 관리하는 계획을 수립하고 영향을 주는 치명적인 X들을 주기적으로 모니터링하며, 이상 원인에 의한 변동을 감지하는 활동을 한다. 관리 대상인 CPP의 특성에 따라 다양한 관리도가 사용된다. 관리도는 측정된 데이터들이 3표준편차로 벗어나는 지를 쉽게 확인할 수 있으며, 나타나기 힘든 확률을 가진 일정한 패턴이 나타날 때도 이상 징후로 판단하여 빠른 조치를 할 수 있도록 모니터링 기능을 가지고 있다. 5단계를 모두 수행하면 과제가 완료되었다고 보는데, 우수한 수준의 과제는 포상과제로 선정하여 과제활동에 대한 긍정적 인식과 함께 주요 결과물을 필요에 따라 발표회를 갖고 다른 과제를 수행할 때 참조할 수 있도록 한다(Kim and Rhee, 2017; Choi, 2021).
2.4 QbD 단계와 6시그마 방법론의 비교
6시그마는 의약품의 공급 부족사태나 리콜(Recall)을 방지하고 지속적 개선을 추진하는데 도움이 되는 의약품 제조 품질 기법이라고 미국 식품의약품안전처(FDA)의 CDER(Center for Drug Evaluation and Research) OPQ(Office of Pharmaceutical Quality)의 부 책임자인 Lawrence Yu 박사가 2018년 ISPE 연속제조 워크숍에 참석해 ‘의약품 품질의 미래(The Future of Pharmaceutical Quality)’라는 제목으로 의약품 제조 현장의 6시그마 기법 도입에 필요에 대한 사항을 발표했다. QbD는 명확한 제품 개발 목표와 제품 및 공정에 대한 철저한 이해와 제어를 통해 품질 위험을 철저히 관리하는 과학적이고 체계적인 의약품 개발방법으로서 QbD를 통해 현재 2~3 시그마 수준의 의약품 품질수준을 6시그마 수준까지 올릴 수 있다(Kim and Rhee, 2020).
Table 3은 QbD 단계 별로 실행항목과 사용하는 도구들을 정리하고 6시그마의 단계로 사용도구 관점에서 함께 정리하였다. QbD와 6시그마 실행의 가장 큰 공통점은 통계분석기법을 활용한다는 것이다. QbD 단계에서의 사용되는 통계기법들과 6시그마 실행에서 사용되는 통계기법들이 동일함을 알 수 있다. QbD의 첫 번째 단계라고 볼 수 있는 품질목표사항 단계는 6시그마의 첫 번째 단계인 Define과 비슷하다. 개선의 대상이 되는 Y를 QbD에서는 핵심 품질특성라고 부르고, 6시그마 방법론에서는 Project Y라고 부른다. 둘은 같은 개념이다. 핵심품질특성도 정량적일 수 있고, 정성적일 수 있다. Y에 영향을 주는 X에 대해서는 6시그마 방법론은 잠재인자(Potential X), 가인자(Possible Factor), 치명인자(Vital few or Big X)라고 부른다. QbD에서는 공정과 물질로 구분하여 CPP와 CMA를 각각 PP와 MA에서 찾는다. 이 때 사용되는 기법이 고장모드영향분석(Failure Mode Effect Analysis, FMEA)의 위험평가(Risk Assessment, RA)방법 중 가장 광범위하게 사용되는 위험순위평가(Risk Priority Number, RPN)이다(Cho and Lee, 2022).
QbD에서는 공정분석기술(Process Analytical Technology, PAT)을 중요하게 다룬다. PAT는 공정의 완료 시점에서의 최종 제품 품질 적합성을 보증하기 위하여 원료, 공정 중간물질 그리고 공정의 품질 및 성능 요소들의 실시간 또는 고속 측정에 근거하는 제약공정의 지속적 분석 및 제어를 위해 설계되는 통합 시스템으로서 QbD에서 강조하는 공정 이해를 위한 전제 조건으로 볼 수 있다. 공정의 모든 주요 변인들이 확인되고 설명되어야 하고, 그 변인들은 공정에 의해 제어될 수 있어야 하며, 제품의 품질 특성 예측은 정확하고 신뢰할 수 있어야 한다. 공정 이해의 정도와 공정 위험의 정도는 역수 관계다. PAT에서의 Analytical의 의미는 통합 분석(Integrated Analysis)의 개념으로 화학적 분석, 물리적 분석, 미생물학적 분석, 위험 요인 분석 및 수학적 통계적 분석을 포함한다(Lee and Lee, 2021). QbD가 강조하는 PAT는 4차산업혁명 시대의 제조지능화 활동의 결과물로 볼 수 있으며, 가상물리시스템(Cyber Physical System, CPS)과 다른 형태의 제약업계의 스마트팩토리(Smart Factory)이다. 연속생산(Continuous Manufacturing)시대에 지능화된 공정의 실시간 시험(Real Time Release Test, RTRT)이 가능해진다. 단, 모든 생산공정의 시스템 제어는 GMP 기준에 부합해야 한다(Kim and Rhee, 2017).
3. QbD 6시그마 제안
본 논문에서는 선행연구를 바탕으로 제약 현장에서의 QbD 실행력 강화를 위하여 성과 중심의 검증된 경영혁신 기법인 6시그마 제도 및 방법론을 접목하여 LG화학 생명과학본부에서 실행한 성과를 바탕으로 제약업계 현장에 적합한 QbD 6시그마 교육체계와 역량 인증제도의 도입을 제안한다. 국내 제약회사에서는 QbD를 실행하기 위해서 식약처나 보건복지부 산하 교육기관에서 무료로 제공되는 교육이나 세미나를 통해 직원들을 교육하고 있다. 단편적인 교육을 이수한 경우 QbD의 전체 프로세스를 충분히 이해하지 못하고 단편적으로 해석하고 적용하는 문제가 있다. 제약회사에서 QbD를 빠른 시기에 도입하고 내재화하기 위해서는 숙련된 품질경영전문가(Master Black Belt, MBB)의 주도로 6시그마 프로세스를 제약회사 맞춤형으로 개선한 QbD 6시그마를 소개하고자 한다.
3.1 QbD 6시그마 벨트 체계
QbD 6시그마 GB(Green Belt)과정의 시작은 기본적인 통계 교육에 대해 선행학습이다. 온라인 교육이나 1일 8시간 정도의 기본적인 통계에 대한 학습을 받은 후, QbD의 전반적인 내용이 들어간 QbD 기본통계 과정을 3일 간의 집체교육을 받는다. 기본통계 과정을 학습하고 QbD 기본통계를 이수하면 QbD GB교육을 이수한 것이 된다. QbD BB(Black Belt)는 2단계에 해당되는 벨트로서 중급의 능력을 의미한다. QbD 실험통계와 QbD 관리통계로 구분하여 운영하고, 두 과정을 모두 이수하여야 QbD BB 인증 자격을 갖추게 된다. QbD 실험통계에서는 QbD에서 DS를 수립하는 데 필요한 다양한 실험계획법을 집중적으로 학습하고, QbD 관리통계에서는 QbD에서 관리전략을 수립하는 데 필요한 통계기법들에 대해 학습한다. QbD 6시그마 GB과정을 이수하고, 프로젝트를 1건 수행한 후 심사를 거쳐 QbD GB를 인증하고, 이후에 QbD BB 과정인 QbD 실험통계와 QbD 관리통계를 이수하고, 프로젝트를 1건 수행한 후에 QbD BB로 인증한다. QbD BB의 경우는 이론평가 및 통계분석역량을 확인할 수 있는 실습평가를 반드시 수행하고, 필요에 따라 구술평가를 병행하여 QbD 6시그마 전문가로서 역량을 확인하여 인증한다.
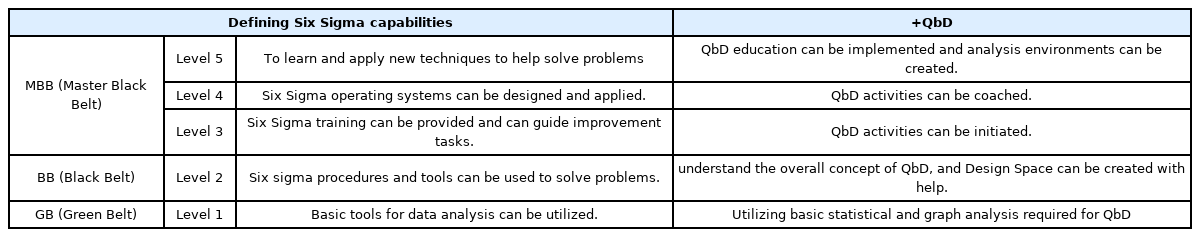
3.2 QbD 6시그마 벨트역량
Table 4는 QbD 6시그마의 Belt에 대한 역량을 정의하였다. QbD GB는 QbD 활동에 필요한 기술통계 및 그래픽 분석을 사용할 수 있는 정도의 역량이다. QbD BB는 QbD의 전반적인 개념을 이해하면서 DS를 도움을 받아 설정할 수 있는 정도의 역량이다. QbD 6시그마 중급 수준의 전문가라고 볼 수 있다. QbD MBB는 구체적으로 Level을 구분하였다. QbD MBB Level3는 QbD 활동을 할 수 있는 역량이다. QbD MBB의 Level4는 QbD 활동을 지도할 수 있는 역량이다. QbD MBB Level5는 QbD 실행을 위한 분석 환경을 개발하고 교육 운영할 수 있는 역량이다. QbD MBB Level3 부터를 QbD MBB로 인증을 하고, Level에 관한 구분을 따로 하지 않고 MBB로 부른다.
QbD는 연구개발단계에서 실행되므로 QbD 6시그마 벨트교육 및 인증 대상도 제약회사의 연구원이다.
3.3 QbD 6시그마 교육 콘텐츠
Table 5는 QbD 6시그마의 벨트교육에 대한 콘텐츠이다. QbD 6시그마를 통해 제약업에 신속하게 QbD에 대한 이해와 실행 방법을 체계적으로 교육하는데 도움이 되었다.
QbD 6시그마는 교육을 이수한 후에 QbD 6시그마 과제를 진행하게 하여 연구원들이 QbD를 실행하는데 도움을 주고, Belt제도와 연계하여 실행력을 강화할 수 있다. 6시그마 벨트를 승진이나 조직책임자 임명에 기본적인 조건으로 하였다. 신약의 후보물질을 탐색하는 조직과 인원을 제외하고 생명과학 R&D분야의 전 사원이 참여하여 QbD 6시그마 교육에 참여하였다. QbD 6시그마 GB에서는 일반적인 6시그마 개념과 기초통계를 배우고, QbD의 전반적인 개념과 QbD에서 강조하는 제품의 이해에 포함되는 QTPP와 CQA에 대한 개념을 포함한다. 그리고 가설검정과 추정에 대한 학습을 한다. 필요에 따라서는 2일 간 강의가 가능하도록 설계할 수 있지만, 3일 간의 학습을 통해 중요한 개념은 반복학습을 할 수 있도록 한다. QbD 6시그마 BB과정은 2개 과정으로 모듈형태로 진행하고, 순서가 있지는 않다. 우선 QbD 실험통계에서는 QbD에서 강조하는 공정의 이해에 해당되는 CPP와 CMA에 대한 학습과 DS에 대한 개념을 학습하고, 상관분석과 회귀분석을 사례를 통해 학습하고, QbD 실행에 도움이 되는 다양한 DOE기법들에 대해 학습한다. 3일간 실습을 병행하며 집중적으로 실험설계법에 대해 학습한다. QbD 관리통계에서는 QbD에서 강조하는 공정관리 단계에 해당되는 CS에 대해 학습하고, 측정시스템 분석(Measurement System Analysis; MSA)과 통계적 공정관리(Statistical Process Control; SPC)에 대해 학습하고 공정능력분석에 대해 학습하여 공정의 현 수준을 통계적으로 제시할 수 있도록 학습한다. QbD 6시그마와 GB를 인증 받고 QbD 6시그마 실험통계와 관리통계 교육을 이수한 후 과제를 수행하여 담당 MBB에게 인증을 받으면 사내 QbD 6시그마 BB로 추천을 받는다.
개인에 따라 차이는 있지만, QbD GB에서 BB까지는 평균적으로 1년에서 1년 6개월 정도 소요된다. QbD GB는 Table 6과 같이 입사 2년 차 내의 신입사원이 할 수 있는 수준의 업무에서 기초적인 통계적 도구를 활용하는 것으로 과제를 수행하게 하여 QbD 6시그마 과제에 대한 부담감과 저항감을 줄일 수 있다. QbD BB는 QbD 6시그마의 전문가로서 입사 10년 차 내의 사원이 통계적 도구를 활용하여 문제해결을 실행한 모든 과제를 QbD 6시그마 BB과제로 인정을 한다. 신약을 개발하는 과정 중에 QbD를 실행하면서 생기는 문제를 통계적 도구로 활용하여 과제를 수행하고 완료하였을 때 인정을 한다. MBB는 약 1년 6개월 이상의 기간이 소요되는 것이 적당하다. QbD 6시그마 과제를 진행하는 것이 소요되는 기간의 대부분이다. QbD 6시그마는 개인의 통계적 분석역량을 중요하게 생각하기 때문에 과제를 통한 문제 해결 역량을 보는 것이 아니므로 시간에 제약을 두어서는 안 된다. QbD 6시그마를 제약업에 적용하면서 가장 문제될 수 있는 부분이 QbD 6시그마 과제의 범위다. 전통적인 6시그마 과제의 로드맵인 DMAIC를 따르지 않을 수도 있다. 상황에 따라서는 생략되거나 축소되는 단계가 있을 수 있고, 어떤 단계에서는 더욱 강화된 형태로 진행될 수 있다.
4. QbD 6시그마 적용 사례
LG화학 생명과학본부는 QbD 6시그마를 본부조직의 MBB 1인의 주도하에 구축하였다. MBB는 LG전자에서 체계를 구축한 경험이 있는 전문가를 영입하였다. 연구소와 3개 지역의 공장에 각 조직별 임원급 경영진이 QbD 6시그마의 챔피언 역할로서 과제의 선정과 방향성에 대한 지시를 함으로써 Top-Down 형태의 과제 선정을 하도록 체계를 만들어 실행하였다. 격월 1회 주기적인 챔피언 리뷰를 통해 6시그마 과제의 점검을 받았고, 과제 실행의 충실도 제고에 기여하였다. 본부조직의 MBB를 중심으로 연구조직은 QbD 6시그마를 약 4개월간 TFT를 구성하여 교육용 교재를 개발하였고, 생산 및 품질조직은 GMP 6시그마를 약 3개월간 TFT를 구성하여 교육용 교재를 개발하여 연구조직과 생산 품질조직에 각각 필요한 교육을 실시하였다. 초기에 육성된 BB를 중심으로 생산 품질조직의 GB과제를 지도하였고, 조직책임자인 경우에는 직접 과제의 인증을 하도록 체계를 만들어 실행하였다. 벨트의 최종인증의 경우 GB는 임원급 챔피언, BB인 경우는 사업본부장이 하도록 체계를 만들어 실행하였다.
연구소는 품질개선 중심으로 QbD 6시그마 교육과 체계를 가지고, 생산 현장은 품질관리를 중심으로 하는 QbD 6시그마 교육과 체계를 가져가고 QbD 6시그마 과제활동을 전개하였다. 육성된 BB들의 역할로 각 사업장의 GB과제들을 지원하고 지도하는 체계를 구축하였고, 본부 MBB는 LG화학 생명과학본부 6시그마에 대한 총괄 기획을 담당하고 QbD 6시그마 체계를 구축하고 QbD 6시그마 교육제도를 구축하여 벨트육성을 하였다. 본부 MBB는 BB와 MBB후보 중심으로 이루어진 QbD 6시그마 협의체를 지원하고, QbD 6시그마 협의체 소속의 리더인 BB와 MBB후보들이 GB와 BB과제를 지도 및 지원하는 체계를 만들어 운영하였다. QbD 6시그마 협의체는 6시그마를 꾸준히 접할 수 있는 자발적 학습 동아리의 성격을 동시에 지니고 있고, 구성원들 간의 자발적인 세미나와 토론을 주기적으로 본부 MBB의 입회하에 실시하였다. 모든 조직에는 본부 MBB와 함께 6시그마 교육 참석과 벨트 취득 현황을 주기적으로 관리하는 간사를 두어 본부 MBB를 도와 사내에 QbD 6시그마를 빠르게 전파되는 데 기여하였다. 연구조직의 6시그마 간사는 교재개발 TFT에 참여한 멤버 중에 추천하여 조직 장의 선정으로 임명되어 활동하였다. 6시그마 간사는 연간 업무 목표에 6시그마 간사 역할을 추가하고, 조직 내 교육 참가자 수와 벨트취득 수를 목표로 활동하여 평가를 받았다.
연구조직 대상의 QbD 6시그마 교육은 입문교육으로 1일 8시간의 기초통계교육을 집체교육이나 온라인교육을 통해 실시하여 연구원들의 초기 참여를 용이하게 하였다. QbD의 전반적인 개념과 6시그마의 철학과 사상 및 데이터의 측정척도 및 샘플링 이론 기술통계와 추론통계의 기초적인 내용과 가설검정과 가설추정의 내용으로 구성된 QbD GB 교육을 3일 과정으로 운영하였다. 입문교육과 QbD GB 교육을 이수하고, 과제를 1건 이상 수행하면 과제 평가를 통해 최종적으로 GB에 인증하였다. QbD BB는 QbD 실행에 필요한 다양한 실험계획기법 중심의 실험통계와 QbD의 공정관리 부분에 속하는 관리전략을 실행할 수 있도록 기본적인 통계적 공정관리에서의 관리도 개념과 공정능력분석 및 측정시스템 분석으로 구성된 관리통계를 각각 이수하고 QbD BB과제를 1건 이상 완료하고, 과제평가와 본부 MBB의 구술평가를 통해 최종적으로 BB를 인증하였다. 인증된 GB와 BB들에게는 인사정보시스템에 등재하였고, 진급 시에 가산점을 부여하였다. 6시그마 활성화와 성과에는 경영진의 지원과 후원이 절대적이다. 경영진들은 QbD 6시그마 챔피언으로서 중요 과제를 Top-Down으로 선정하고, 격월로 6시그마 과제 리뷰를 실시하였고, 구성원들의 과제 방향성을 지시하고 활동에 대해 독려하였으며, GB나 BB를 인증 받은 인원에게는 인증서를 수여하여 경영진들의 높은 관심도를 보여주었다. 통계기법에 익숙하지 않은 제약회사 직원들에게 생소한 통계용어나 통계프로그램을 사용하는 것을 교육하는 것이 처음에는 쉽지 않았으나, 신약개발을 위해서 QbD 접근방식은 선택이 아니라 필수라는 점과 조직의 역량을 높이면서 개인의 역량을 높이는 방법임을 꾸준히 강조하여 QbD 6시그마에 대한 저항감을 감소시킬 수 있었다.
5. QbD 6시그마 성과
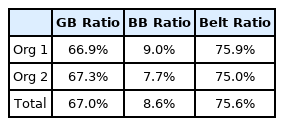
과제를 위한 과제가 아니라 현업의 활동 자체를 6시그마 과제로 인정하였다. LG화학 생명과학본부에서 QbD 6시그마를 도입한 결과에 대한 성과는 Table 7과 같은 벨트 율로 나타내었다. 도입 3년 만에 모든 조직의 벨트 율이 75%을 달성하였는데, 최소 GB교육 이수 및 과제 1건을 성공적으로 수행한 비율이다.
2개 조직으로 구분하여 각각 GB Ratio는 GB 수를 전체 인원수로 비율을 나타냈고, BB Ratio는 BB 수를 전체 인원수로 비율을 나타냈다. Total은 두 조직의 GB 수와 BB 수를 각각 전체 인원수로 비율로 나타냈고, Belt율은 GB와 BB를 합한 수에 전체 인원수의 비율로 나타내었다. LG화학 생명과학본부는 6시그마를 도입하고 1년여 만에 구성원의 75.6%가 QbD 6시그마 GB이상을 획득하는 성과를 내었고, QbD 6시그마 과제 96개를 수행하여 생산성 향상과 품질비용 절감 등에 많은 성과를 내었다. 전자나 자동차 등 제조업 기반의 6시그마가 아니라 제약업의 특성에 맞게 변경한 QbD 6시그마에 대한 구성원의 호응도 좋았고, 교육에 대한 만족도도 높았다. 품질 문제에 대해 발생 후 원인을 분석하는 조직문화해서 적극적으로 품질 문제를 예방하고, 품질 불량을 예측하는 다양한 QbD 6시그마 과제 수행을 통해 QbD 6시그마를 도입한 후 2년 후부터 수십억 원의 품질개선에 따른 경영성과가 있었고, 3년 째 부터는 100억대 4년째에는 300억이 넘는 QbD 6시그마 개선효과를 통해 경영성과에 기여하고 있다. 공정실패에 따른 품질 문제에 대해 단편적인 분석으로 사후처리에만 치중을 하였다면, QbD 6시그마 도입으로 품질문제를 구체적으로 정의하고, 데이터에 근거로 현 수준을 측정하고, 개선방향을 수립하고, 품질 문제를 해결하는데 과학의 언어인 통계적 접근방식을 통해 개인의 역량 향상과 조직의 역량 향상을 동시에 달성하였다.
6. 결 론
지난 2009년 전 세계를 공포에 떨게 했던 신종플루 사태 당시 국내 제약산업의 기술력으로 개발된 국산 백신이 있어서 우리나라는 큰 타격 없이 위기를 극복할 수 있었다. 2019년 전 세계를 공포로 몰고 간 코로나19 사태에서 국가적 위기를 극복한 경험에서 보듯 필수의약품을 우리 힘으로 생산하고 공급할 수 있는 제약주권의 보유 여부는 국민의 생명과 건강에 직결되는 의약안보에 절대적이다. 또한 제약산업은 생물, 미생물, 화학 등 기초과학, 약학, 의학, 통계 등의 융복합적 산업 특성을 가지고 있고 부가가치가 크고 양질의 일자리를 창출하는 선진국형 성장동력 산업이다. (Yim, 2018) 세계 50대 제약회사를 보유한 국가에는 미국 16개사, 일본 9개사, 독일 5개사, 스위스4개사, 영국 3개사로 1~5위를 하고 있으며, 인도와 남아프리카공화국을 빼면 모두 유럽과 북미 그리고 일본이 산업을 선도하고 있음을 보여준다. 제약산업은 인간의 생명에 관련된 제품을 개발하고 생산하는 산업으로 우수 의약품 개발 및 접근성 제고를 통해 질병으로 인한 사회적 비용 감소 국민건강증진 및 생존권 확보와 직결되어 있다. 또한 바이오기술(BT; Biotechnology)이 응용 접목되는 여러 산업 분야 중 80%의 비중을 차지하고 있다. 제약산업이 확장되고, 연관된 보건의료 시장은 계속 증가할 것으로 전망된다. 150여 년 이상 발전을 지속해 온 제약산업의 새로운 전환기에 대응하기 위해 대내외적으로 힘든 여건에 놓여 있으나 위기 상황을 글로벌 경쟁력을 가질 수 있는 제약산업으로 변신할 수 있는 절호의 기회이다.
신약개발에 QbD를 적용할 것을 ICH와 각국 규제기관에서 권고하고 있고, 글로벌 신약개발회사로 성장하기 위해서는 필수적이 되었다. 본 연구는 QbD를 제약업계에 빠르게 접목하기 위해 6시그마의 철학과 교육체계 및 Belt체계까지 제약업에 조화롭게 적용할 수 있도록 교육과정을 새롭게 개발하여 QbD 6시그마를 개발하고 운영한 성과를 바탕으로 제안하였다. 국내 제약회사에 맞게 제안한 QbD 6시그마가 많은 현장에 적용되기를 희망한다. QbD 6시그마가 국내 제약회사들이 글로벌 신약개발 회사로 발전하는 데 기여할 것으로 확신한다.